Sicherheit bei der Unterscheidung zwischen hochdifferenzierten und niedrig differenzierten Hirntumoren
Ärzte des Phoenix Children's Hospital (PCH) untersuchen den Wert von APT in der klinischen Praxis, um zu ermitteln, inwieweit APT-gewichtete Bildgebung in der diagnostischen und posttherapeutischen Bildgebung bei Kindern mit Hirntumoren verwendet werden kann. Die Ergebnisse deuten darauf hin, dass APT-gewichtete Bildgebung das Potenzial hat, mehr Sicherheit bei der Bestimmung des Tumorgrads und der Größe des Residualtumors nach der Operation zu bieten. Viele Behandlungen stützen sich bei der Auswahl der optimalen Behandlungsoption auf die genaue Bestimmung der Aggressivität oder des „Grads“ von Tumoren, sodass dem Patienten die bestmögliche Versorgung angeboten werden kann.
Amid Proton Transfer (APT)-gewichtete Bildgebung ist ein neues MRT-Verfahren, dessen Bildkontrast sich vom konventionellen MRT unterscheidet. APT-gewichtete Bildgebung ist ein MRT-Verfahren auf Grundlage des chemischen Austausch-Sättigungs-Transfers (CEST), und das Signal basiert auf der Konzentration von endogenen Proteinen und Peptiden, die typischerweise in hochdifferenziertem Hirntumorgewebe vorliegen. Daher erfordert APT-gewichtete Bildgebung kein Kontrastmittel mehr.
„Einige hochdifferenzierte Tumoren zeigen keine Gadolinium-Anreicherung und manche niedrig differenzierte Tumoren reichern es gelegentlich an.“

John Curran, MD
Kinder-Neuroradiologe und Leiter der pädiatrischen Neuroradiologie am Phoenix Children's Hospital. Zu seinen Interessengebieten gehören die Bildgebung bei pädiatrischen Hirntumoren und Epilepsie.

Jeffrey H. Miller, MD
Pädiatrischer Neuroradiologe und stellvertretender Leiter der Radiologie für Forschung und akademische Wissenschaft am Phoenix Children’s Hospital. Akademische Ämter, die er bekleidet, sind Clinical Assistant Professor of Radiology am University of Arizona College of Medicine, an der Mayo Clinic-Scottsdale und am Barrow Neurological Institute beim Phoenix Children’s Hospital. Sein derzeitiges wissenschaftliches Interesse gilt der funktionellen MRT, der MR-Konnektomik und der Hirn-PET-CT. Er übt umfangreiche Lehrtätigkeiten über neueste pädiatrische MR-Bildgebung aus.
Auf der Suche nach mehr Sicherheit in der Hirntumordiagnostik
MRT wird in der Onkologie häufig zur Visualisierung von primären Hirntumoren und Sekundärläsionen verwendet. Der hervorragende Weichteilkontrast und die funktionelle Bildgebung liefern Radiologen Informationen zu Lokalisierung, Größe, Morphologie, Gewebezusammensetzung und Physiologie von Läsionen, die bei Diagnostik und Staging helfen. Dennoch gibt es Fälle, in denen sich Radiologen weitere Funktionen für die Diagnose wünschen, z.B. für die sicherere Unterscheidung zwischen hoch- und niedrig differenzierten Tumoren und schließlich für die Durchführung der zahlreichen MRT-Nachuntersuchungen von Kindern nach der Hirntumorresektion ohne Kontrastmittelgabe. Alleine in den USA werden im Jahr 2017 schätzungsweise 80.000 neue Fälle von primären Gehirntumoren diagnostiziert. Diese Zahl umfasst mehr als 26.000 primäre maligne Hirntumoren.[1] Gliome stellen 75% aller malignen Tumoren dar, und bei 55% davon handelt es sich um Glioblastome mit voraussichtlich 12.930 Fällen im Jahr 2017.[1,2] Angesichts dieser Inzidenz und der Auswirkungen der korrekten Diagnose und angemessenen Behandlungspfade schätzen Onkologen und Radiologen
innovative Tools zur Unterstützung ihrer aktuellen Verfahren und Strategien. Eines davon könnte die zusätzliche APT-gewichtete Bildgebung in MRT-Untersuchungen sein. Der APT-Kontrast korreliert mit dem Vorliegen von Proteinen und Peptiden, die möglicherweise mit der Zellproliferation in Verbindung stehen. Da Zellproliferation eine Eigenschaft von Tumoren ist, können APT-Farbskalen hilfreich bei der Identifizierung und Quantifizierung von Tumorgewebe sein.[3,4]

Phoenix Children's Hospital
APT spiegelt die Konzentration von endogenen Proteinen im Hirntumor wieder
Bei der APT-gewichteten Bildgebung und anderen CEST-Verfahren wird das MRT-Signal durch einen anderen Mechanismus erzeugt als bei der klassischen MRT-Bildgebung. Diese CEST-Verfahren basieren auf dem chemischen Austausch von Wasserstoffatomen. Das Signal der Amid-Protonen von Peptidketten in Proteinen ist zu gering, um im normalen MRT gemessen werden zu können. Der Wasserstoff (Protonen)-Austausch zwischen Protein-Amidgruppen und umgebendem Wasser eröffnet eine andere Möglichkeit zur Messung dieser Amid-Protonen. Bei APT wird ein enger HF-Vorimpuls (Sättigungsimpuls) mit der Frequenz des Amid-Wasserstoffs abgegeben, um dessen MR-Signal abzuschwächen. Da die Amidgruppe und Wasser kontinuierlich Wasserstoffatome austauschen, steigt die Anzahl der gesättigten Protonen im Wasser, sodass das gemessene Wassersignal abnimmt. Die Veränderung des MR-Signals von Wasser ist eine indirekte Methode zur Messung des Vorliegens von Amiden. APT-Bilder werden normalerweise als eine durch Asymmetrieberechnung erstellte Farbskala dargestellt, wobei APT als positives Farbsignal dargestellt wird.
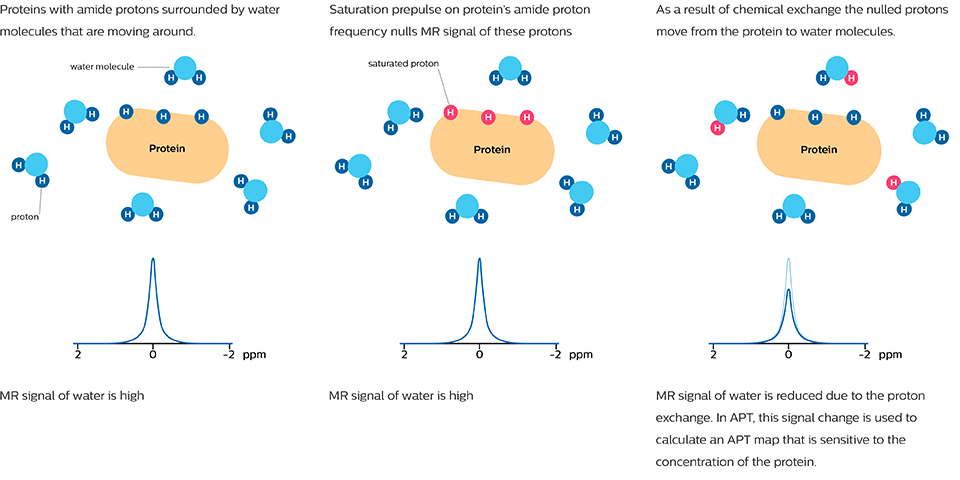
Studien haben gezeigt, dass das APT-Signal mit der Konzentration eines Proteins korreliert, das mit der Zellproliferation in Zusammenhang steht. Die Konzentration dieses Proteins und somit die APT-Signalstärke reagieren auf den Grad von malignen Tumoren.[5-7] Der APT-Kontrast kann potenziell Tumoren markieren, die ansonsten nicht sichtbar wären.
„Einige hoch differenzierte Tumoren zeigen keine Gadolinium-Anreicherung und manche niedrig differenzierte Tumoren reichern es gelegentlich an.“
Der Tumorgrad kann die kritische Entscheidungsfindung beeinflussen Die Wahl des Behandlungspfads hängt oft stark vom Tumorgrad ab. Häufige Behandlungsoptionen für hochdifferenzierte Tumoren umfassen die chirurgische Tumorresektion, gefolgt von zusätzlichen Therapien, z.B. Strahlen- und/oder Chemotherapie. Schnelles und entschiedenes Handeln ist in diesen Fällen wünschenswert, da die mittlere Überlebensdauer bei Glioblastomen zwischen 12,6 und 14,6 Monaten liegt, obwohl auch längere Zeiträume berichtet wurden.[8,9] Angesichts der niedrigeren Wachstumsrate von niedrig differenzierten Tumoren besteht eine Reihe von möglichen Behandlungsoptionen für diese Fälle. Die Auswahl der am besten geeigneten Behandlung basiert auf dem Gleichgewicht von therapeutischen Vorteilen und Nebenwirkungen. Manchmal kann überwachende Bildgebung eine Rolle spielen, während die Möglichkeiten für die definitive Therapie gegeneinander abgewogen werden.[10] MR-Bildgebung wird häufig von Radiologen und Ärzten bei der Einschätzung des Grads von Hirntumoren genutzt, doch manchmal besteht weiterhin Unsicherheit.[9,11] Die Unterscheidung zwischen niedrig differenzierten und hochdifferenzierten Tumoren ist selbst für erfahrene Radiologen nicht einfach. Die Gadoliniumanreicherung ist nicht immer spezifisch für den Tumorgrad, da einige hochdifferenzierte Tumoren keine Gadoliniumanreicherung zeigen und bestimmte niedrig differenzierte Tumoren gelegentlich anreichern (z.B. DNET). Eine Gadoliniumanreicherung tritt auch bei jeglichen Störungen der Blut-Hirn-Schranke auf, etwa bei behandlungsbezogenen Verletzungen.[12] Die Leistung von APT bei der Einstufung von Hirntumoren mit MRT Während der Goldstandard für die Einstufung von Gliomen die Histopathologie nach Biopsie ist, wird MRT häufig in der Überwachung von Gliompatienten genutzt, und APT kann bei diesen Patienten eine wertvolle Ergänzung zur MRT-Untersuchung darstellen. Tumorgrad und APT-Signal korrelieren häufig positiv: Hoch differenzierte Tumoren zeigen eher einen hohen APT-Kontrast.[12-15] APT-Bilder visualisieren Tumoren stärker als kontrastverstärkte Bilder, wodurch die Aufnahme möglicherweise leichter zu interpretieren ist. Wissenschaftliche Studien, in denen Tumorgrade mit APT-Signal bei Gliomen von Erwachsenen verglichen wurden, deuten darauf hin, dass APT die Tumoreinstufung unterstützen kann, indem hochdifferenzierte von niedrig differenzierten Tumoren getrennt werden, selbst wenn das herkömmliche MRT nicht eindeutig ist.[5,13,14]
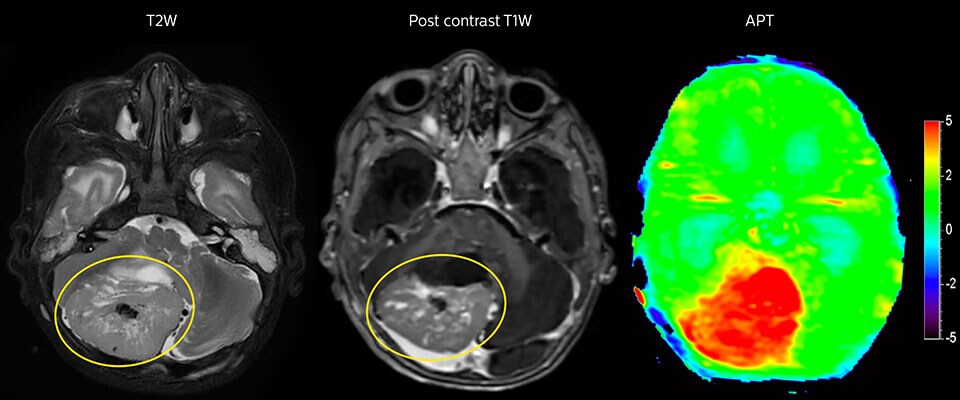
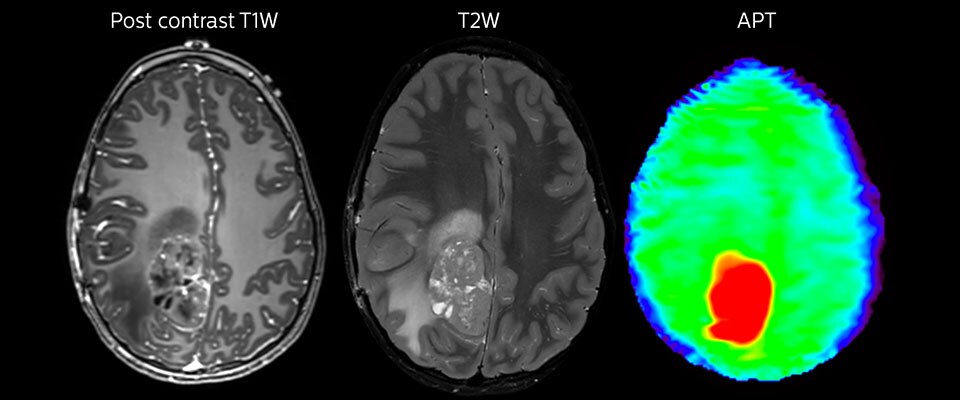
APT-Bildgebung eines hoch differenzierten Tumors
Tumorauswertung bei einem 1-jährigen Kind mit Medulloblastom. Dieser aggressive Tumortyp ist sehr solide und homogen. Das hohe APT-Signal entspricht dem kontrastverstärkten Bild dieses hoch differenzierten Tumors.
APT kann eine leistungsstarke Ergänzung für die Einstufung von Tumoren mit MRT darstellen
Dr. Jeffrey Miller, Kinderradiologe am PCH, ist in Studien an seinem Krankenhaus auch die Beziehung zwischen APT-Kontrast und Tumorgrad aufgefallen. „In mehreren Fällen haben wir ein starkes APT-Signal bei hochdifferenzierten Tumoren und ein mäßig erhöhtes APT-Signal bei mittelgradig und niedrig differenzierten Tumoren festgestellt, die die Eigenschaft einer starken Signalveränderung bei T2 und FLAIR und keine Kontrastverstärkung aufweisen.“ Er weist auf die potenziellen klinischen Implikationen dieser Beobachtung hin: „Wenn wir Patienten mit nicht ganz eindeutiger Diagnose haben, müssen wir Entscheidungen treffen und Beurteilungen einschätzen, wobei wir entweder den Tumor oder die Läsion einfach beobachten und das Risiko eingehen, dass er oder sie sich bei einer falschen Einschätzung verändern könnte und Zeit verloren geht. Oder wir müssen invasiv handeln und Biopsien entnehmen.“ „Es wäre sehr hilfreich und wertvoll, eine Sequenz wie APT-gewichtete Bildgebung zu haben, die uns dabei hilft, solche Entscheidungen mit höherer Sicherheit zu treffen. Das wäre für den einzelnen Patienten sinnvoll und reduziert Mehrdeutigkeiten.“ „Um dieses hohe Ziel zu erreichen, benötigen wir allerdings mehr Forschung, müssen die Sequenz in einer größeren Population anwenden und besser verstehen, in welchen Situationen und unter welchen Bedingungen APT den größten Nutzen hat.“
„Es wäre sehr hilfreich und wertvoll, eine Sequenz wie APT-gewichtete Bildgebung zu haben, die uns dabei hilft, solche Entscheidungen mit höherer Sicherheit zu treffen. Das wäre für den einzelnen Patienten sinnvoll und erleichtert unsere Arbeit um gewisse Mehrdeutigkeiten.“
APT kann Bilder nach der Resektion um wichtige Informationen ergänzen
Eine MRT kann nach der Tumorresektion erfolgen, um auf Residualtumorgewebe oder erneutes Tumorwachstum zu untersuchen. Auch hier können die verschiedenen Kontrastmechanismen von APT die Diagnose unterstützen. Dr. Miller erinnert sich an einen bestimmten Fall. „Nach einer sehr guten Resektion sahen wir kleine Veränderungen auf den kontrastverstärkten T1-gewichteten und T2-gewichteten Bildern, die wie eine geringe Menge postoperativer Flüssigkeit aussahen. Interessanterweise sahen wir jedoch auch einen fokalen Bereich mit einem APT-Signal direkt in der Mitte der Anomalie. Wie immer, wenn wir ein wenig unsicher sind, führten wir weitere Untersuchungen durch und fanden leider neues Tumorwachstum in dieser Region“, so Dr. Miller. „Fälle wie dieser motivieren mich und andere, die sich um dieses Patientenklientel kümmern, zu untersuchen, wie dieses APT-Verfahren auf hohem Niveau für diese Patienten genutzt werden könnte und uns hilft, hochwertige diagnostische Informationen zu erhalten.“ Die Ärzte des Krankenhauses hatten auch einen Fall, in dem APT negativen Vorhersagewert hatte. Nach der Resektion eines hoch differenzierten Tumors gab es eine ähnliche geringfügige Veränderung auf den Bildern dieses Patienten. In diesem Fall war das APT-Signal jedoch ziemlich niedrig. In einem kürzlich durchgeführten Scan des Patienten wurde kein Rezidiv festgestellt.
„Solche Fälle motivieren mich, zu untersuchen, wie APT in größerem Umfang eingesetzt werden könnte.“
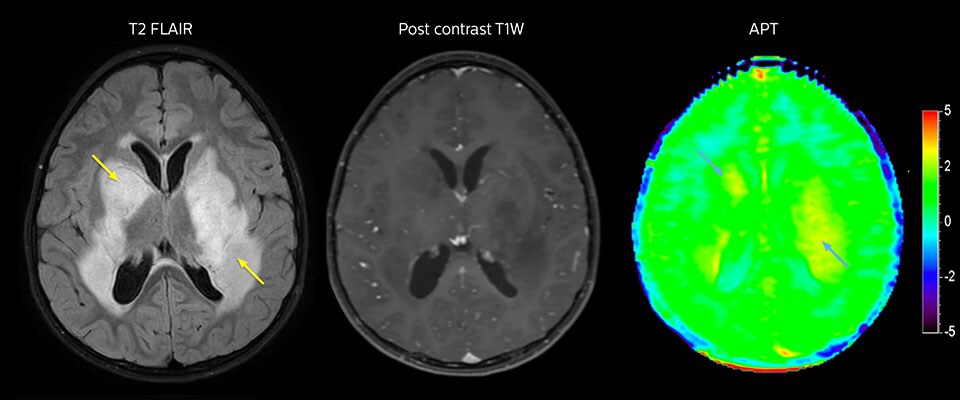
APT-Bildgebung eines niedrig differenzierten Tumors
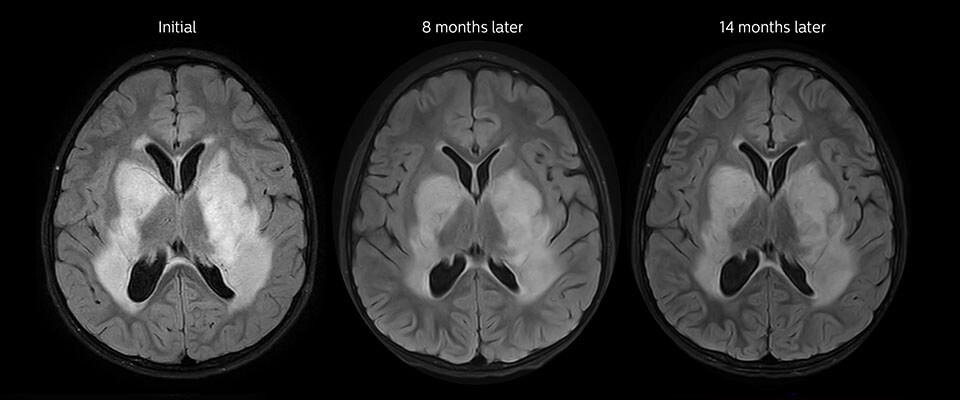
Niedrig differenziertes Gliom bei einem 5-jährigen Patienten mit Neurofibromatose 1. Diese niedrig differenzierte Läsion zeigt auf kontrastverstärkten Bildern keine Anreicherung, aber ein mittelgradiges APT-Signal. Die Stabilität der Läsion über die Zeit bestätigt, dass es sich um eine pathologische Veränderung niedriger Differenzierung handelt.
Nachuntersuchung im Laufe der Zeit
„In vielen Fällen haben wir beobachtet, dass APT positiv ist, wenn die kontrastverstärkte T1-gewichtete Bildgebung positiv ausfällt.“
APT-MRT-Studien sind auch für die kleinsten Tumorpatienten vielversprechend
Der Radiologe John Curran, MD, war leitender Forscher bei der Untersuchung der APT-gewichteten Bildgebung am Phoenix Children's Hospital. „Bis jetzt wurde APT bei etwa 70 MRT-Studien an Kindern mit Gehirntumoren eingesetzt, und wir haben bereits einige ermutigende Erstergebnisse“, so John Curran, MD, Radiologe am Phoenix Children's Hospital (PCH). „Wir brauchen größer angelegte Studien mit mehr Patienten, um die Korrelation genau zu ermitteln. Jedoch muss es keine 100%ige Korrelation sein, um bei Nachuntersuchungen von Hirntumoren nützlich zu sein, da wir auch FLAIR und andere Bilder betrachten. Das Ziel ist, etwas zu identifizieren, bevor es zu groß wird, und zu ermitteln, ob es eine neue Operation oder neue Therapie erfordert, und wenn wir etwas Verdächtiges sehen – im Gegensatz zu einem definitiven Rezidiv – ist das oft nicht eine Sache des sofortigen Handelns, sondern der Nachuntersuchung.“
Die an der Studie beteiligten Ärzte des PCH sind vorsichtig optimistisch, dass APT-gewichtete Bildgebung irgendwann den Einsatz von Kontrastmitteln bei pädiatrischen Patienten deutlich reduzieren kann. „Wenn wir APT als angemessenen Ersatz voranbringen können, wäre es insbesondere bei unseren Gehirntumorfällen in der Nachuntersuchung von großem Vorteil“, sagt Dr. Curran. „Die Verwendung von Kontrastmitteln wird in unserer allgemeinen Neuroradiologie-Bildgebung streng überwacht, und Kontrastmittel wird nur verabreicht, wenn es wirklich erforderlich ist. Daher konzentriert sich unsere Studie darauf, zu bestimmen, ob wir in der Zukunft APT nutzen können, um den Einsatz von Kontrastmitteln zu verringern.“
„APT wurde bei etwa 70 MR-Untersuchungen von Kindern mit Hirntumoren eingesetzt, und wir haben einige ermutigende Erstergebnisse.“
Vielversprechende Ergebnisse mit APT inspirieren weitere Pläne
Dr. Curran verglich bei Kindern mit einer Anamnese von Hirntumoren APT-gewichtete Bildgebung mit kontrastverstärktem MRT. „In vielen Fällen haben wir gesehen, dass APT positiv ausfällt, wenn kontrastverstärkte T1-gewichtete Bildgebung positiv ist. Deshalb versuchen wir, zu beurteilen, ob diese Beziehung stark genug ist, um APT unter bestimmten Umständen möglicherweise zu verwenden, anstatt einem Kind Kontrastmittel zu verabreichen. In der Studie wird APT-Forschungssoftware genutzt, die in einer Forschungszusammenarbeit von Philips entwickelt wurde.
„Gehirntumor-MRTs umfassen in der Regel kontrastverstärkte Bildgebung. In unserer jungen Patientenpopulation gelten unsere Bedenken der Verabreichung von Gadolinium-basierten Kontrastmitteln bei Nachuntersuchungsscans von Kindern nach einer Hirntumorresektion. Eine von meinem Kollegen Dr. Miller veröffentlichte Studie zeigte, dass sich bei einer Tumorresektion im Kindesalter bis zum jungen Erwachsenenalter eine deutliche Gadoliniummenge im Gehirn abgelagert hat.[16] APT erfordert kein Kontrastmittel. Wenn wir APT als angemessenen Ersatz fördern können, insbesondere in unseren Nachuntersuchungsfällen bei Hirntumoren, wäre es von großem Vorteil.“
APT bei der postoperativen Beurteilung
Große metastatische Hirnläsion
Diese 10-jährige Patientin unterzog sich vor 7 Jahren der Resektion eines Ewing-Sarkoms, doch jetzt wurde eine große metastatische Läsion im Gehirn entdeckt. Diese Läsion zeigt deutlich ein erhöhtes APT-Signal.
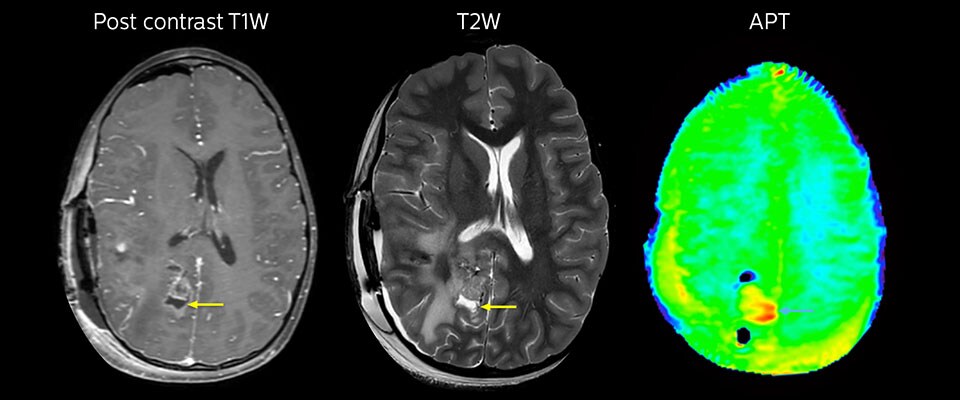
MRT mit APT nach der Resektion
Unmittelbar nach der Resektion wurde erneut eine MRT durchgeführt. Die T2-gewichteten und kontrastverstärkten T1-gewichteten Bilder lassen keine eindeutige Unterscheidung von Residualtumorgewebe und postoperativen Gewebeveränderungen zu. Auf dem APT-Bild ist noch ein hohes Signal zu sehen, das auf Residualtumorgewebe hindeuten würde.
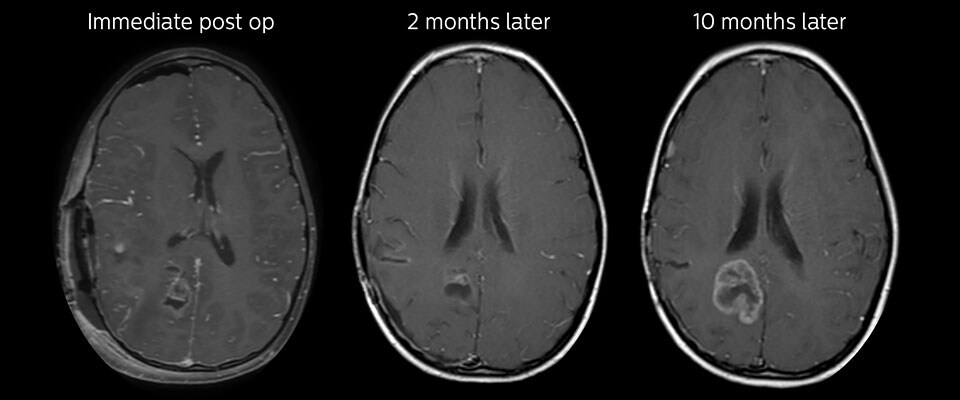
Nachuntersuchung im Laufe der Zeit
In späteren Nachuntersuchungsscans weisen die kontrastverstärkten T1-gewichteten Bilder auf rezidivierendes Tumorwachstum hin. Daher wäre es interessant, den prädiktiven Wert von APT in einer großen Patientengruppe zu untersuchen.
Vorfreude auf weitere Forschungsarbeiten zum Potenzial von APT
Laut Dr. Curran lag der APT-Forschungsschwerpunkt am PCH bisher auf der Untersuchung der Möglichkeiten für die Visualisierung von Hirntumoren und dem Potenzial, den Bedarf nach Kontrastmittel zu senken. „Wir hoffen, dass APT uns in Zukunft helfen kann, Tumoren mit MRT besser zu charakterisieren. Zuvor sind jedoch weitere Forschungsarbeiten notwendig, bis wir wissen, was möglich und effektiv ist. Durch das Betrachten spezifischer Aspekte von APT-positiven Tumoren hoffen wir, das APT-Signal genauer mit histologischen Ergebnissen oder Tumormarkern zu korrelieren.“
„Wir hoffen in Zukunft auf einen Test, der uns bei der Therapieentscheidung unterstützt, etwa bei der Auswahl von Chemotherapeutika, mit oder ohne Strahlentherapie und so weiter. Vielleicht hat APT in Zukunft das Potenzial, uns hier auf irgendeine Weise zu unterstützen“, so Dr. Curran. „Die Möglichkeiten scheinen sehr umfassend zu sein.“
Dr. Miller fasst abschließend zusammen: „Wir haben bereits sehr gute Erfahrung mit der Anwendung eines APT-Verfahrens in klinischen Situationen gemacht. Wir haben viel über den Prozess gelernt und sehen für ihn großes Zukunftspotenzial.“
„Wir haben bereits sehr gute Erfahrungen mit der Anwendung eines APT-Verfahrens in klinischen Situationen gemacht.“
Literatur:
1.American Brain Tumor Association, Brain Tumor Statistics. 9. Lobera, A, Coobs, B, Naul, LG, Zee, CS. Imaging in Glioblastoma Multiforme. Medscape. 13. Park KJ, Kim HS, Park JE et al. Added value of amide proton transfer imaging to conventional and perfusion MR imaging for evaluating the treatment response of newly diagnosed glioblastoma. Eur Radiol 2016, 26: 4390; doi: 10.1007/s00330- 016-4261-2.
2.Central Brain Tumor Registry of the United States, 2016 CBTRUS Fact Sheet.
3.Togao O, Hiwatashi A, Keupp J, Yamashita K, Kikuchi K, Yoshiura T, Yoneyama M, Kruiskamp MJ, Sagiyama K, Takahashi M, Honda H. Amide Proton Transfer Imaging of Diffuse Gliomas: Effect of Saturation Pulse Length in Parallel Transmission-Based Technique. PLOS ONE 2016; doi: 10.1371/journal.pone.0155925.
4. Togao O, Keupp J, Hiwatashi A, Yamashita K, Kikuchi K, Yoneyama M, Honda H. Amide Proton Transfer Imaging of Brain Tumors Using a Self-Corrected 3D Fast Spin-Echo Dixon Method: Comparison with Separate B0 correction Magn Res Med 2016 early view; doi: 10.1002/mrm.26322.
5. Togao O, Yoshiura T, Keupp J, Hiwatashi A, Yamashita K, Kikuchi K, Suzuki, YS, Iwak, T, Hata N, Mizoguchi M, Yoshimoto K, Sagiyama K, Takahashi M, Honda H Amide proton transfer imaging of adult diffuse gliomas: correlation with histopathological grades. Neuro-Oncology 2014; 16(3), 441–448.
6.Jiang S, Eberhart CG, Zhang Y, Heo HY, Wen Z, Blair L, Qin H, Lim M, Quinones- Hinojosa A6, Weingart JD, Barker PB, Pomper MG, Laterra J, van Zijl PCM, Blakeley JO, Zhou J. Amide proton transfer-weighted magnetic resonance image-guided stereotactic biopsy in patients with newly diagnosed gliomas. Eur J Cancer 201783:9-18; doi: 10.1016/j.ejca.2017.06.009.
7. Zhou, J. (2011). Amide Proton Transfer Imaging of the Human Brain. Magnetic Resonance Neuroimaging. Methods in Molecular Biology (Clifton, N.J.), 711, 227–237.
8.American Brain Tumor Association, Brain Tumor Information, Types of Tumors, Glioblastoma (GBM)
10.Paleologos, N. Low Grade Glioma: Update in Treatment and Care. ABTA Patient and Family Conference, 2014.
11.Upadhyay, N, Waldman, A D, Conventional MRI evaluation of gliomas. The British Journal of Radiology 2011; 84: S107–S111.
12. Wen, Z, Hu, S, Huang, F, Wang, X, Guo, L, Quan, X, Wang, S, Zhou, J, MR Imaging of High-Grade Brain Tumors Using Endogenous Protein and Peptide- Based Contrast. NeuroImage 20110; 51(2), 616–622.
14. Park JE, Kim HS, Park KJ, Kim SJ, Kim JH, Smith SA. Pre- and Posttreatment Glioma: Comparison of Amide Proton Transfer Imaging with MR Spectroscopy for Biomarkers of Tumor Proliferation. Radiology 2016, 278:514; doi: 10.1148/ radiol.2015142979.
15. Wang X, Yu H, Jiang S, Wang Y, Wang Y, Zhang G, Jiang C, Song G, Zhang Y, Heo H-Y, Zhou J, Wen Z. Qualitative and quantitative analysis of amide proton transferweighted MR images at 3 Tesla of adult gliomas. Abstract #1105, ISMRM 2017.
16. Miller JH, Hu HH, Pokorney A, Cornejo P, Towbin R. MRI Brain Signal Intensity Changes of a Child During the Course of 35 Gadolinium Contrast Examinations. Pediatrics 2015;136;e1637.
